Tudo o que os doentes precisam de saber sobre o Aduhelm (aducanumab) | New Alzheimer's Medicine
Última atualização: 15 de março de 2022

Pode aceder legalmente a novos medicamentos, mesmo que estes não estejam aprovados no seu país.
Saiba comoArtigo revisto pelo Dr. Jan de Witt
Em 7 de junho de 2021, a FDA aprovou o aducanumab (produzido sob o nome comercial "Aduhelm") para o tratamento da doença de Alzheimer, aumentando as esperanças de milhões de doentes de Alzheimer e das suas famílias em todo o mundo, enquanto os especialistas manifestavam as suas preocupações relativamente à decisão.
Aduhelm é o primeiro medicamento para a doença de Alzheimer a ser aprovado pela FDA em 18 anos. De acordo com os resultados publicados, este medicamento pretende ser capaz de retardar a progressão da própria doença de Alzheimer, em vez de aliviar os seus sintomas.
A decisão da FDA de aprovar o medicamento tem sido repleta de controvérsia. No entanto, a Biogen, o fabricante do Aduhelm, espera começar a enviar Aduhelm para mais de 900 centros de saúde nos Estados Unidos até ao final de junho de 2021.
Aduhelm está atualmente disponível para doentes adequados fora dos Estados Unidos da América numa base de uso compassivo ou de doente nomeado. Para saber mais, consulte a secção "Acesso ao Aduhelm fora dos Estados Unidos".
A doença de Alzheimer: uma das maiores crises sociais, médicas e económicas do século XXI
A doença de Alzheimer é uma doença degenerativa do cérebro que afecta atualmente mais de 40 milhões de pessoas em todo o mundo e é a causa mais comum de demência. Considerada durante muitos anos como uma parte normal do envelhecimento, a doença de Alzheimer é agora reconhecida como uma doença com graves repercussões sanitárias, económicas e sociais.
Os investigadores ainda não compreendem totalmente o que causa a doença de Alzheimer, mas pensa-se que é causada por uma combinação de factores, tais como:
- Envelhecimento: A doença de Alzheimer é mais frequentemente diagnosticada após os 65 anos de idade (doença de Alzheimer de início tardio). Cerca de um terço das pessoas com 85 anos ou mais tem a doença de Alzheimer. As alterações no cérebro relacionadas com o envelhecimento podem contribuir para o desenvolvimento da doença.
- Historial familiar: Ter um familiar de primeiro grau com Alzheimer aumenta o risco de uma pessoa desenvolver a doença. Os cientistas acreditam que uma predisposição genética pode causar a doença de Alzheimer de início precoce, que ocorre em pessoas entre os 30 e os 60 anos. Apenas 10% dos doentes de Alzheimer têm a forma precoce da doença.
- Outros factores: Os cientistas descobriram ligações entre o declínio cognitivo e as doenças cardíacas, bem como a diabetes e a obesidade. As provas mais fortes associam a saúde do cérebro à saúde do coração. Os traumatismos cranianos também foram associados a um risco acrescido de Alzheimer, uma vez que podem desencadear a formação de placas amilóides. As pessoas com síndrome de Down, em que um cromossoma extra determina a codificação genética de um tipo de proteína amiloide associada à doença de Alzheimer, também correm um risco acrescido.
A maioria das pessoas com doença de Alzheimer é diagnosticada na fase ligeira, quando os sintomas se tornam mais pronunciados e a doença já causou alguns danos cerebrais, apesar de alguns sintomas começarem a aparecer mesmo uma década antes do diagnóstico. Os primeiros sintomas podem ser ignorados pelos doentes (muitas vezes devido à vergonha) ou simplesmente não serem notados pelos médicos ou familiares. Os doentes têm uma esperança média de vida de 3-11 anos após o diagnóstico.
"Com o tempo, a mamã esqueceu-se de quem eu era"
A doença de Alzheimer tem três fases diferentes:
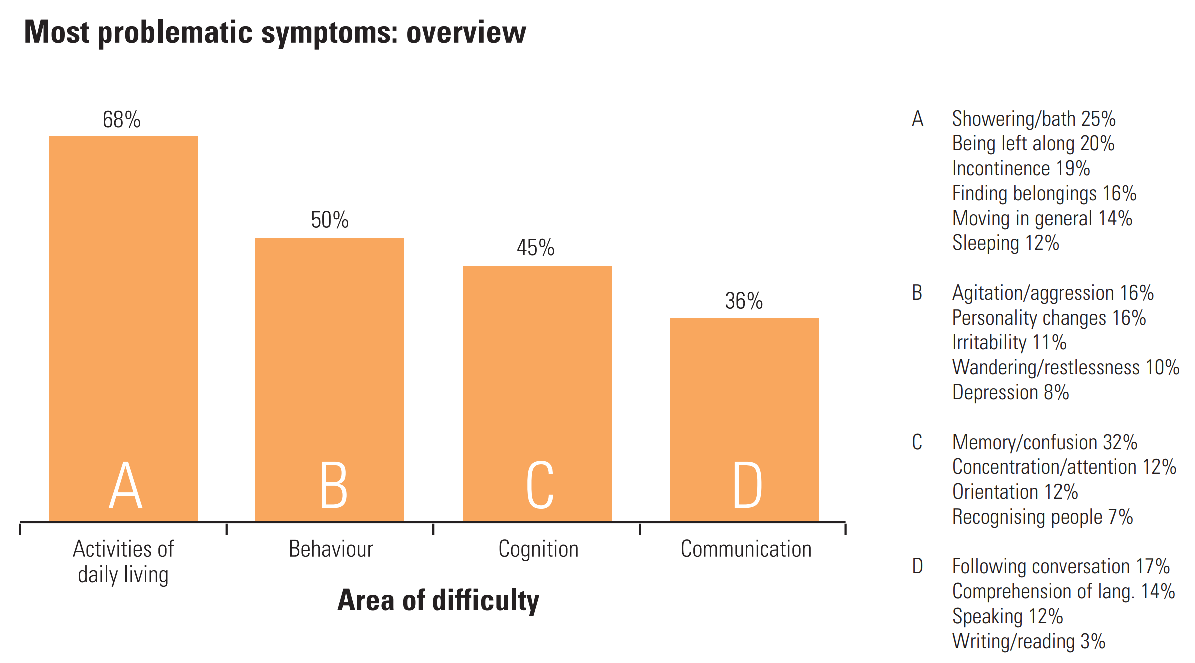
- Ligeira: Nos primeiros estágios, os pacientes experimentam perda de memória, como esquecer datas e eventos importantes, repetir perguntas com frequência, levar mais tempo para concluir tarefas diárias, problemas constantes com finanças, perder itens com frequência e ansiedade. (Para saber mais sobre o grau de perda de memória que é normal com o envelhecimento, consulte esta infografia do National Institutes of Health (NIH)'s National Institute on Aging).
- Moderada: À medida que a doença progride, os doentes apresentam um aumento da perda de memória e confusão, dificuldade de comunicação e de leitura, dificuldade em tarefas de rotina como vestir-se, problemas em reconhecer a família e os amigos, paranoia, alucinações e deambulação.
- Grave: Os doentes com Alzheimer grave apresentam incapacidade de comunicar, perda de peso, dificuldade em engolir e perda de controlo dos intestinos e da bexiga. Nesta fase, os doentes estão na cama a maior parte do tempo e dependem totalmente de outros para cuidar deles.
As dificuldades dos doentes de Alzheimer são terríveis, uma vez que a doença tem impacto em todos os aspectos da sua vida quotidiana. Em baixo, pode ler algumas histórias de doentes ou de amigos e familiares de doentes.
Sandy, um antigo dentista e professor assistente em Harvard, falou aos repórteres da CNN sobre o facto de se ter apercebido de que o seu esquecimento tinha progredido para algo pior: "'Estou a olhar para um processo dentário durante uma hora e meia', recorda ele. Estou a lê-lo, está no meu cérebro. Depois, fechava o ficheiro e não me lembrava literalmente de nada sobre o caso'". Pouco tempo depois, foi-lhe diagnosticada a doença de Alzheimer.
Fred Walker, cuja mulher foi diagnosticada com a doença de Alzheimer, falou à Alzheimer's Research UK sobre a sua mulher: "Usar o telefone tornou-se impossível para ela. Ela não conseguia dominar todos os botões. O fogão era demasiado complexo para o compreender e havia sempre o perigo de ela deixar o gás ligado. Para ela, fazer uma chávena de chá era demasiado complicado e confundia-se com a quantidade de chá, leite e água necessária.
A doença de Alzheimer, quando atinge as fases mais avançadas e evolui para demência, é descrita por Laury para a Alzheimer's Society:
"[...] embarcámos numa nova viagem. Uma que envolvia cuidados 24 horas por dia, rondas diárias de medicação e o facto de a mãe se perder completamente no nevoeiro da sua própria mente. [Só nessa altura é que se apercebeu do espetáculo de horror que era ver um ente querido com esta doença cruel e insidiosa. [...] Ela começou a alucinar".
O fundador da everyone.org , Sjaak Vink, confirma e reconhece todas e cada uma destas descrições. A sua mãe foi-lhe diagnosticada a doença de Alzheimer em 2015.
É um caminho difícil para os doentes e para os seus entes queridos - e a doença não se limita a afetar apenas a sua vida pessoal e a vida dos seus entes queridos.
Pressão sobre os prestadores de cuidados, os orçamentos e os decisores políticos
Os doentes com Alzheimer necessitam de cuidados cada vez mais exigentes à medida que o seu estado se deteriora, tais como cuidados ao domicílio, cuidados noturnos, serviços de limpeza ou cuidados de enfermagem; eventualmente, os doentes podem ter de viver em centros de assistência ou lares. A doença tem um custo elevado para o doente, para os seus familiares (que muitas vezes se dedicam a cuidar do doente) e para os seus orçamentos pessoais e do Estado.
Os familiares prestadores de cuidados enfrentam uma missão difícil quando cuidam dos seus entes queridos com a doença de Alzheimer. Um inquérito revelou que 95% dos familiares prestadores de cuidados no Reino Unido afirmam que a doença afecta a sua saúde física ou mental, 69% dizem sentir-se constantemente exaustos, 64% ansiosos e 49% deprimidos.
Na Europa, a doença de Alzheimer e outras formas de demência afectam cerca de 10 milhões de pessoas, prevendo-se que esse número aumente para 14 milhões até 2030. Estima-se que o custo económico da demência na Europa aumente para mais de 250 mil milhões de euros até 2030, sendo que mais de 50% deste valor se deve aos custos dos cuidados informais. O acesso aos cuidados e ao tratamento é desigual e, sobretudo na Europa de Leste, faltam sistemas de apoio e programas sociais para os doentes de Alzheimer e os seus prestadores de cuidados.
Nos Estados Unidos, a doença de Alzheimer entrou recentemente na lista das 10 principais causas de morte e é a única das 10 principais que não tem cura conhecida. Afecta 6 milhões de pessoas nos EUA e prevê-se que esse número aumente para 12 milhões em 2050. No final de 2021, o custo total nacional dos cuidados prestados às pessoas que vivem com Alzheimer e outras demências poderá atingir 355 mil milhões de dólares e prevê-se que atinja 1,1 triliões de dólares em 2050.
Este financiamento, por mais astronómico que possa parecer, é necessário para oferecer aos doentes um apoio adequado e, tanto quanto possível, uma vida digna.
Devido aos cuidados permanentes necessários, especialmente nas fases mais avançadas, os doentes com Alzheimer são particularmente afectados quando os cuidados são inadequados, o que acontece em muitos países ou comunidades. Só no Reino Unido, dezenas de milhares de pessoas com demência são admitidas todos os anos nas urgências devido a infecções, quedas e desidratação, que resultam de cuidados insuficientes. Este facto sobrecarrega ainda mais os orçamentos nacionais dos cuidados de saúde.
Durante a pandemia de COVID-19, os doentes de Alzheimer foram gravemente atingidos e sofreram um elevado número de mortes devido à idade, a outros problemas de saúde de longa duração e aos próprios desafios da doença de Alzheimer (por exemplo, problemas de memória e confusão que fazem com que os doentes tenham dificuldade em seguir as orientações que previnem as infecções por COVID-19).
Os doentes de Alzheimer internados em lares de idosos também sentiram as consequências nefastas de outras formas. Devido à insuficiência de cuidados e à separação forçada dos seus entes queridos para os manter a salvo da COVID-19, a solidão e o isolamento daí resultantes deterioraram ainda mais a sua saúde mental e física.
São necessários tratamentos eficazes para a doença, a fim de evitar que as crises sanitária e económica atinjam proporções graves.
Destaques da investigação sobre a doença de Alzheimer
Em 1910, Emil Kraepelin, um médico alemão, deu à doença o nome de "doença de Alzheimer", em homenagem ao médico Alois Alzheimer, que descobriu as caraterísticas patológicas da demência pré-senil num doente com uma profunda perda de memória e um agravamento das alterações psicológicas. A investigação de tratamentos para a doença de Alzheimer só começou no final da década de 1980 nos Estados Unidos, mas enfrentou críticas porque os médicos ainda acreditavam que a doença de Alzheimer era uma consequência inevitável do envelhecimento.
Nos Estados Unidos, em 1978, o National Institute on Aging (NIA) e a Alzheimer's Association associaram-se à Pfizer e iniciaram o primeiro ensaio clínico de um medicamento destinado a tratar os sintomas da doença de Alzheimer. O medicamento foi aprovado em 1993: O Cognex (tacrina), de acordo com os resultados publicados, melhorou as capacidades cognitivas de alguns doentes, mas não impediu o agravamento da doença.
Na década seguinte, foram aprovados mais seis medicamentos, todos para tratar os sintomas cognitivos da doença de Alzheimer:
- Aricept (donepezil): para o tratamento de sintomas relacionados com a memória e o pensamento
- Razadyne (galantamina): para o tratamento de sintomas relacionados com a memória e o pensamento
- Exelon (rivastigmina): para o tratamento de sintomas relacionados com a memória e o pensamento
- Namenda (memantina): para melhorar a memória, a atenção, o raciocínio e a linguagem
- Namzaric (memantina + donepezil): uma combinação das anteriores
- Belsomra (Suvorexant): para o tratamento da insónia em doentes de Alzheimer
O último medicamento a ser aprovado para o tratamento da doença de Alzheimer foi aprovado em 2003. Durante décadas, a doença de Alzheimer foi considerada uma consequência natural do envelhecimento. Poucos recursos foram dedicados à procura de um tratamento, uma vez que se discutia se se tratava de uma doença real. Nos últimos 20 anos, no entanto, os investigadores dedicaram amplos recursos ao estudo da doença e ao desenvolvimento de um tratamento.
A falta de tratamentos para a doença de Alzheimer não se deve a negligência por parte das empresas farmacêuticas - a indústria em geral investiu milhares de milhões em investigação. Só a empresa Eli Lilly gastou 4,2 mil milhões de dólares ao longo de três décadas a tentar desenvolver um medicamento de sucesso, e os Institutos Nacionais de Saúde dos Estados Unidos (NIH) gastam mais de 500 milhões de dólares por ano na investigação e desenvolvimento de tratamentos.
Desde 2013, o Congresso dos Estados Unidos triplicou o orçamento anual dos NIH para o financiamento da investigação da doença de Alzheimer e demências relacionadas, atingindo 3,1 mil milhões de dólares em 2019.
O financiamento nacional e privado resultou em 2173 ensaios clínicos realizados até 2019 para testar várias teorias. As principais teorias testadas:
- 19% dos ensaios centraram-se na hipótese de um neurotransmissor
- 17,0% dos ensaios testaram uma hipótese de cascata mitocondrial e outras hipóteses relacionadas
- 12,7% testaram a hipótese de propagação do tau
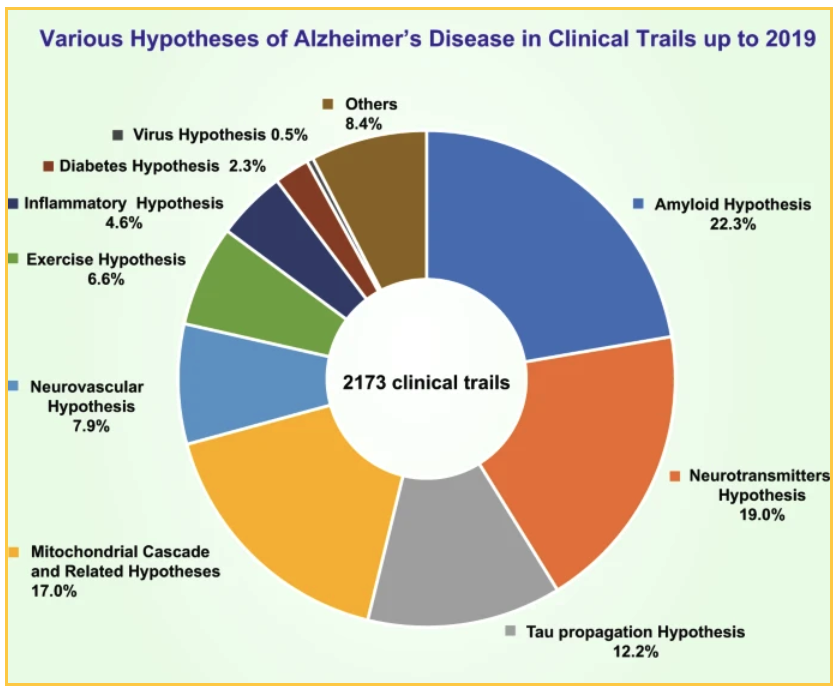
Os 22,3% dos ensaios que visam a amiloide centram-se em diferentes formas de reduzir a placa:
- Anticorpos gerados pelo sistema imunitário contra a beta-amiloide: "Vacinas activas" que, quando injectadas no corpo, desencadeiam o sistema imunitário para produzir anticorpos que destroem a beta-amiloide e reduzem os níveis de beta-amiloide no cérebro.
- Anticorpos contra a beta-amiloide produzidos em laboratório: "Vacinas passivas", que são consideradas mais eficazes e seguras do que tentar induzir a produção de anticorpos no organismo.
- Diminuição da produção de beta-amiloide: Alguns tratamentos experimentais alteram o comportamento de determinadas proteínas que podem impedir ou reduzir a produção de beta-amiloide.
- Prevenir a agregação de beta-amiloide: Os cientistas estão a investigar medicamentos que impedem as interações iniciais entre a beta-amiloide e as células cerebrais que levam à morte da célula cerebral.
- Aumentar a remoção da beta-amiloide: Técnicas como a mobilização do sistema imunitário para atacar a beta-amiloide ou a administração de agentes naturais com efeitos anti-amilóides.
- Agentes naturais com efeitos anti-amilóides: A imunoglobulina intravenosa (IVIg) obtida de dadores de sangue humano contém anticorpos naturais que podem reduzir os níveis de beta-amiloide.
O que é o Aduhelm aducanumab-avwa)?
Aduhelm (aducanumab) é um anticorpo anti-amiloide indicado para o tratamento da doença de Alzheimer. Destina-se a remover as placas beta-amilóides que se formam entre as células cerebrais em quantidades anormais em doentes com doença de Alzheimer, o que leva à morte das células cerebrais afectadas. A beta-amiloide foi identificada em 1984 e foi rapidamente considerada o principal fator desencadeante da lesão das células cerebrais, enquanto em 1986 foi identificada a proteína tau, um componente-chave dos emaranhados e um segundo fator desencadeante da deterioração das células cerebrais.
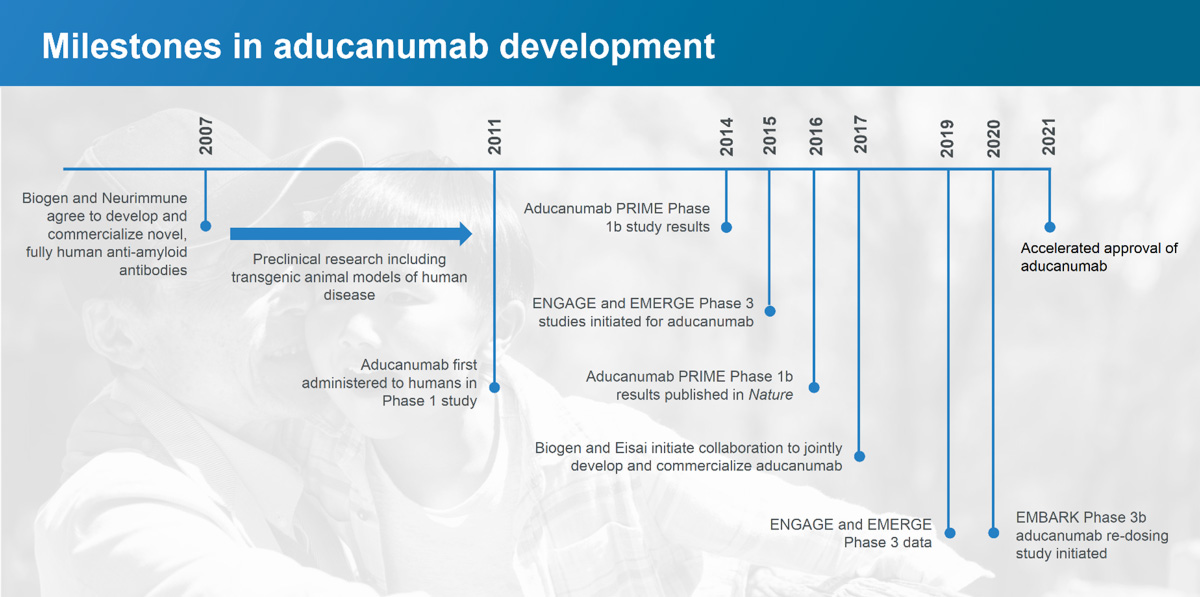
Aduhelm foi desenvolvido pela Biogen, Inc., uma empresa multinacional de biotecnologia com sede em Massachusetts, nos Estados Unidos. Aduhelm é administrado sob a forma de uma injeção mensal.
Aduhelm tem uma longa história.
A empresa suíça de biotecnologia Neurimmune Therapeutics AG, em colaboração com a Universidade de Zurique, identificou os anticorpos anti-amiloide protectores em idosos saudáveis e em doentes com demência de progressão lenta e levou à descoberta do aducanumab, o ingrediente ativo do Aduhelm. Em doentes com doença de Alzheimer ligeira, um ano de perfusões intravenosas mensais de aducanumab reduz a placa amiloide, o que resulta num abrandamento do declínio cognitivo.
A Neurimmune licenciou o aducanumab para o tratamento da doença de Alzheimer à Biogen em 2007 e trabalha em colaboração com a Biogen no seu desenvolvimento.
Como é que Aduhelm funciona?
A doença de Alzheimer parece ser o resultado da acumulação invulgar no cérebro de duas proteínas, a beta-amiloide e a tau. A beta-amiloide é uma proteína que está normalmente presente no cérebro e que, na doença de Alzheimer, se aglomera em placas amilóides entre as células cerebrais - a teoria da amiloide afirma que estas placas danificam e acabam por matar as células cerebrais. As placas amilóides parecem desenvolver-se mais cedo na doença, enquanto os emaranhados de tau tendem a aparecer mais tarde na doença. Grande parte da investigação efectuada para encontrar um tratamento para a doença de Alzheimer centrou-se na remoção das placas amilóides.
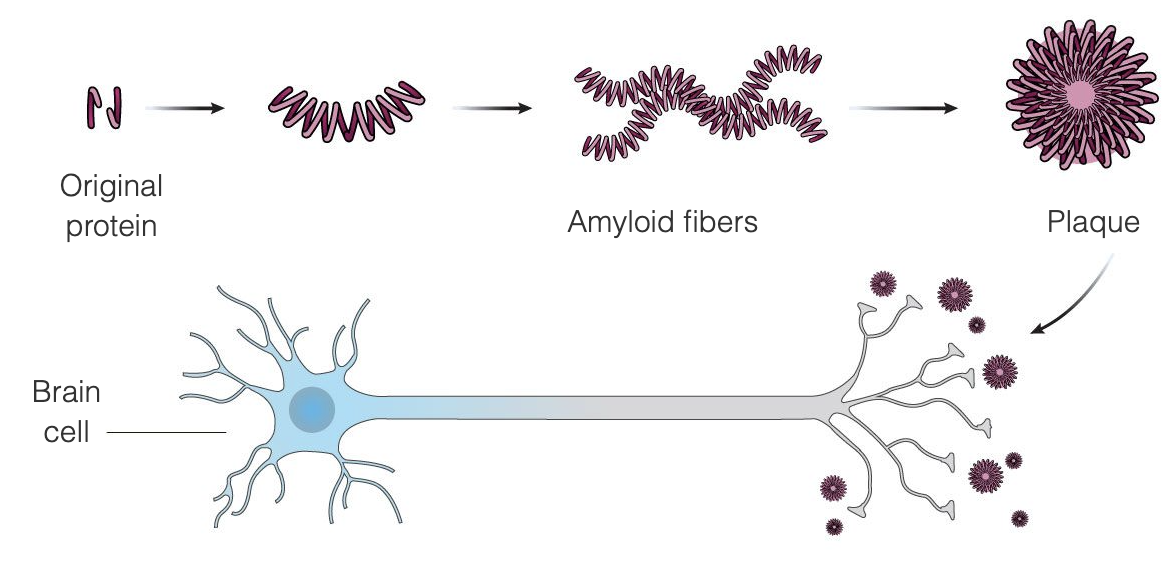
Aduhelm foi concebido para tratar a doença de Alzheimer nas fases muito precoces da doença, ligando-se às placas amilóides, desencadeando assim o sistema imunitário para destruir as placas, vendo-as como um invasor estranho. A intenção é que, uma vez removidas as placas, as células cerebrais deixem de morrer e a função cognitiva pare de se deteriorar. Aduhelm está a utilizar este mecanismo com o objetivo de abrandar a progressão da doença, dirigindo-se particularmente aos doentes nas fases iniciais da doença de Alzheimer. Aduhelm não inverte os danos que já foram causados.
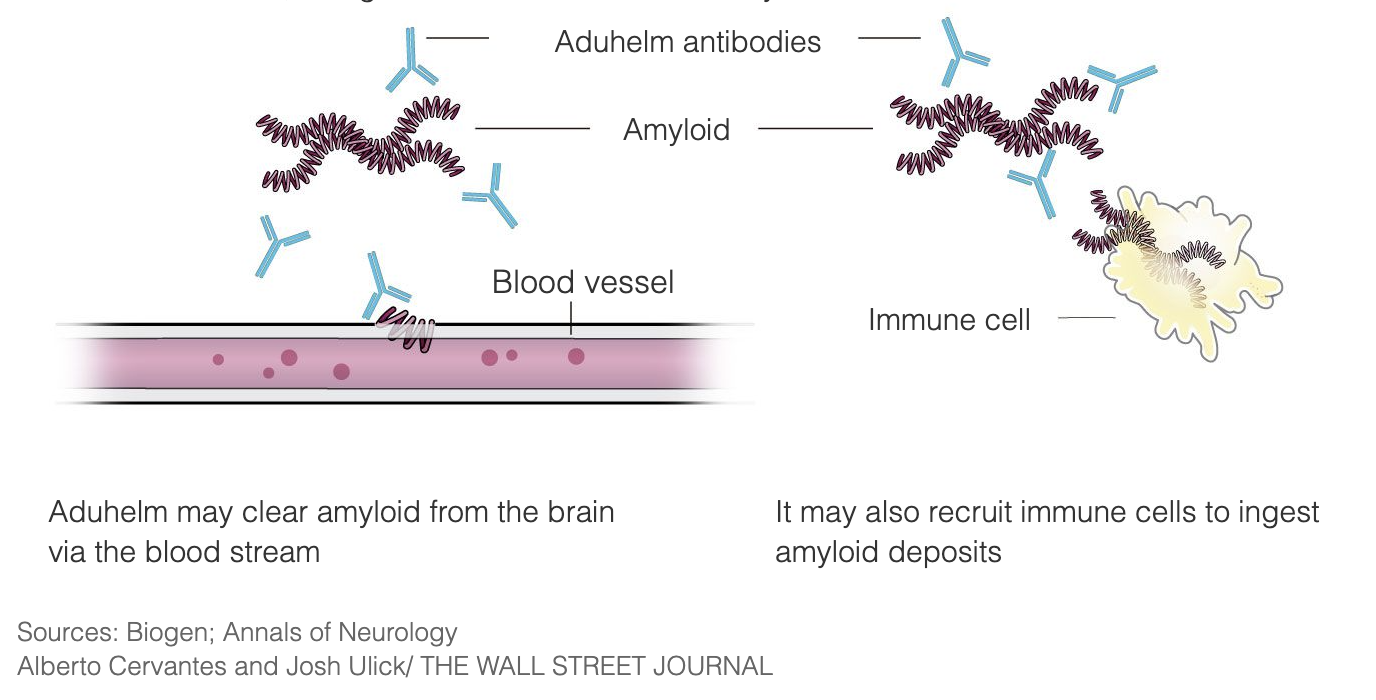
As placas amilóides têm sido um alvo da investigação e do desenvolvimento de medicamentos para a doença de Alzheimer desde há 3 décadas, e Aduhelm é um dos tratamentos que têm sido investigados ao longo dos anos.
"A Igreja do Santo Amiloide"
Os cientistas ainda não estão de acordo sobre as causas da doença de Alzeimer, mas têm algumas teorias. Uma delas chama-se "a hipótese amiloide" e Aduhelm foi desenvolvido com base no pressuposto de que esta teoria está correta.
A hipótese amiloide afirma que a formação de placas amilóides entre as células cerebrais provoca a morte das células, o que leva ao declínio cognitivo. É uma teoria de longa data que nunca foi universalmente aceite - e o fracasso até agora dos ensaios clínicos que visam as placas amilóides encorajou os seus críticos. Há quem chame ao grupo de apoiantes da teoria "a Igreja do Santo Amiloide", devido à sua relutância, quase recusa, em aceitar teorias alternativas.
Mesmo a função normal do beta-amiloide no cérebro é contestada pelos investigadores, uma vez que não estão de acordo quanto ao papel que desempenha naturalmente no corpo humano ou se é estritamente um marcador da doença de Alzeimer.
Um contra-argumento comum à hipótese amiloide é o facto de se encontrarem placas no cérebro de muitas pessoas idosas com uma cognição normal. Curiosamente, alguns exames post-mortem de pessoas com mais de 90 anos com memórias extraordinárias revelaram placas amilóides nos seus cérebros em graus variados - alguns deles tinham uma densidade tão elevada que se assemelhavam aos casos mais graves de Alzheimer, e também tinham muito mais neurónios do que as pessoas que tinham morrido com Alzheimer.
Alguns investigadores acreditam que a beta-amiloide pode ter um papel protetor.
George Perry, neurobiólogo da Universidade do Texas em San Antonio, sugere que "a acumulação de beta-amiloide e tau é, na verdade, uma resposta protetora às pressões metabólicas relacionadas com a idade na célula", sendo particularmente útil para reduzir o stress oxidativo no cérebro (o stress oxidativo aumenta com a idade, o que danifica as células).
Vários estudos investigaram outras causas potenciais da doença de Alzheimer. Um desses estudos foi conduzido por investigadores da Icahn School of Medicine at Mount Sinai, em Nova Iorque, que descobriram que duas estirpes de um vírus chamado HHV (parte da família dos herpesvírus) se encontram em maior quantidade no cérebro de pessoas com doença de Alzheimer. Embora não seja certo que estes dois vírus causem a doença (o mais provável é que a causa seja a combinação do vírus com uma certa variante do gene chamada APOE), os dados sugerem que a infeção aumenta o risco de desenvolver Alzheimer e que as pessoas tratadas com medicamentos antivirais têm dez vezes menos probabilidades de desenvolver Alzheimer.
Em apoio à teoria da amiloide, no entanto, há descobertas genéticas que ligam problemas genéticos relacionados com a amiloide ao desenvolvimento da doença de Alzheimer de início precoce (em pessoas com idades compreendidas entre os 30 e os 65 anos). A síndrome de Down é considerada um fator de risco, uma vez que os investigadores descobriram que as pessoas com síndrome de Down têm uma cópia extra de um cromossoma que contém o gene que codifica uma proteína amiloide associada à doença de Alzheimer de início precoce.
Outras anomalias genéticas podem levar à produção de variantes mais longas de beta-amiloide que formam placas mais facilmente, ou aumentar a produção de beta-amiloide e causar casos algo raros de doença de Alzheimer de início precoce. Vários membros de uma família podem ser portadores destas mutações genéticas e aumentar o risco de um indivíduo desenvolver doença de Alzheimer de início precoce.
Os apoiantes da teoria da amiloide sugerem que os ensaios anteriores que envolveram medicamentos que tinham como alvo as placas amilóides eram simplesmente imperfeitos. Por exemplo, um estudo sobre o semagacestat, um inibidor da produção de proteínas beta-amilóides, piorou a cognição dos participantes do estudo; os investigadores também observaram um aumento do cancro da pele entre os participantes. Isto pode dever-se ao facto de o semagacestat inibir também a produção de outras proteínas, e não apenas da beta-amiloide, algumas das quais têm funções importantes no corpo humano.
A explicação mais apoiada para o fracasso destes ensaios que têm como alvo os amilóides é que os medicamentos são os medicamentos certos, mas administrados no momento errado da progressão da doença de Alzheimer - são administrados demasiado tarde no processo de formação das placas amilóides, um processo que começa décadas antes do aparecimento dos sintomas.
Michael Murphy, um neurocientista da Universidade de Kentucky, observa que "provavelmente já temos um medicamento que poderia tratar a doença de Alzheimer, se o déssemos a pessoas na casa dos 50 anos".
Existe um debate significativo sobre as causas da doença de Alzheimer e os especialistas ainda não estão alinhados - mas os doentes e os investigadores ganharam novo fôlego com os resultados do aducanumab num dos ensaios clínicos de fase 3 da Aduhelm.
Aduhelm em ensaios clínicos
Os ensaios clínicos decorrem em quatro fases:
- Fase 0: O medicamento é testado em quantidades muito pequenas em menos de 15 participantes para garantir que não é prejudicial e que o ensaio pode continuar.
- Fase 1: O medicamento é testado em 20 a 80 participantes sem problemas de saúde subjacentes para garantir que não existem efeitos secundários graves. De acordo com a FDA, aproximadamente 70% dos medicamentos passam para a Fase 2.
- Fase 2: O medicamento é testado em várias centenas de participantes com a doença a que o medicamento se destina, durante alguns meses ou anos, para recolher informações sobre a sua eficácia e efeitos secundários. Cerca de 33% dos medicamentos passam para a Fase 3.
- Fase 3: O medicamento é testado num máximo de 3000 participantes com a doença a que se destina e pode durar vários anos. A segurança e a eficácia do medicamento devem ser comprovadas. 25-30% dos medicamentos passam para a Fase 4.
- Fase 4: Esta fase envolve milhares de participantes ao longo de muitos anos e ocorre depois de o medicamento ter sido aprovado pela FDA. O seu objetivo é recolher mais informações sobre a sua segurança e eficácia a longo prazo.
Aduhelm na Fase 1
A Biogen realizou vários ensaios clínicos para investigar o aducanumab, começando com três ensaios de Fase 1 em 2011 que testaram o aducanumab em voluntários saudáveis e em doentes com doença de Alzheimer nos EUA e no Japão, trabalhando com diferentes doses de aducanumab e placebo. Alguns doentes foram incluídos durante mais de 3 anos.
Em 2016, a Biogen publicou os resultados do seu ensaio clínico de Fase 1, no qual os investigadores administraram infusões intravenosas mensais de aducanumab durante um ano a participantes do ensaio com doença de Alzheimer ligeira. Os participantes tratados com aducanumab apresentaram níveis reduzidos de beta-amiloide no cérebro e um abrandamento do declínio cognitivo, medido por uma Classificação Clínica de Demência oficial. Entre os participantes que receberam infusões de aducanumab, os investigadores da Biogen registaram também uma redução dos efeitos secundários, tais como ARIA (anomalias de imagem relacionadas com a amiloide, por exemplo, edema cerebral ou hemorragia no cérebro). A Biogen considerou estes resultados suficientemente encorajadores para avançar para a Fase 2.
Aduhelm na fase 2
A Biogen iniciou os ensaios de Fase 2 no final de 2018 e avaliou a segurança da dosagem contínua de aducanumab, para além de verificar a redução das placas amilóides e o abrandamento do declínio cognitivo em participantes com doença de Alzheimer em fase inicial e sintomática.
O aducanumab falhou o seu objetivo principal de mostrar um declínio cognitivo mais lento aos 12 meses, mas após 18 meses de dados do ensaio terem sido revistos numa reanálise, foram observados efeitos positivos numa das cinco doses - a dose mais elevada de aducanumab. A dose mais elevada demonstrou reduzir as placas amilóides no cérebro, bem como apresentar respostas positivas na cognição.
Foram observados efeitos secundários, tal como na Fase 1, como ARIA (anomalias de imagem relacionadas com a amiloide) em cerca de 10% de todos os participantes, e menos de 15% nos participantes que receberam as doses mais elevadas de aducanumab.
Os resultados de 18 meses do ensaio BAN2401 são impressionantes e fornecem um apoio importante à hipótese amiloide", afirmou Jeff Cummings, diretor fundador do Cleveland Clinic Lou Ruvo Center for Brain Health, numa declaração para a Biospace.
Aduhelm na fase 3
Após os resultados do ensaio de Fase 2, a Biogen realizou dois ensaios de Fase 3, denominados Engage e Emerge, que incluíram cerca de 3300 participantes com doença de Alzheimer relativamente ligeira na América do Norte, Austrália, Europa e Ásia. O inducanumab foi administrado uma vez por mês em doses baixas e altas por injeção na corrente sanguínea e comparado com os resultados dos participantes que receberam um placebo.
Em março de 2019, a Biogen interrompeu os dois estudos de Fase 3, citando uma análise de futilidade realizada por um comité independente de monitorização de dados que concluiu que o aducanumab não parecia estar a funcionar como pretendido.
A decisão afectou 3300 participantes no estudo. Os protocolos para participar no estudo implicavam visitas frequentes e prolongadas e incluíam colheitas de sangue, ressonâncias magnéticas, exames PET e, por vezes, punções lombares. Sete meses após a interrupção dos dois estudos, a Biogen anunciou que uma reanálise de dados adicionais indicava que, em doses elevadas, o medicamento parecia reduzir o declínio cognitivo.
A Biogen escreveu num comunicado de imprensa que os dados adicionais consistem em resultados de um subconjunto de pacientes no estudo Engage de Fase 3 que receberam uma dose elevada de aducanumab e experimentaram uma redução significativa nas deficiências cognitivas e funcionais (memória, orientação, linguagem), bem como benefícios para as actividades da vida diária (fazer tarefas domésticas, fazer compras, viajar independentemente fora de casa). Com base nestes resultados, a Biogen solicitou a aprovação regulamentar para o aducanumab em outubro de 2019 e recebeu-a no início de junho de 2021.
Embora os ensaios clínicos de Fase 3 não tenham sido totalmente conclusivos quanto aos benefícios da terapia em termos de cognição e função, a FDA concluiu que os ensaios demonstraram que o aducanumab, produzido sob o nome comercial Aduhelm, pode reduzir as placas amilóides, o que constituiu a base para a decisão de aprovação acelerada da FDA.
Phil Gutis, participante no ensaio e repórter , escreveu para a plataforma de notícias Being Patient: "Através de uma PET scan de um estudo longitudinal, fiquei a saber que já não tenho amiloide no meu cérebro. O exame, efectuado há cerca de dois anos como parte do estudo Aging Brain Cohort no Penn Memory Center, confirmou as minhas intuições crescentes de que o aducanumab estava de facto a ajudar-me. Comecei a sentir que estava a sair de um nevoeiro mental constante... Pelo lado negativo, as memórias que perdi não voltaram".
Efeitos secundários e contra-indicações do Aduhelm
De acordo com o Guia de Medicação da Biogen, antes de considerar Aduhelm, os doentes devem informar os seus prestadores de cuidados de saúde sobre todas as suas condições médicas, incluindo se:
- estão grávidas ou tencionam engravidar
- estão a amamentar ou tencionam amamentar
Os doentes devem informar os seus profissionais de saúde sobre todos os medicamentos que tomam, incluindo medicamentos sujeitos a receita médica e de venda livre, vitaminas e suplementos de ervas.
De acordo com o Guia de Medicamentos da Biogen, o principal efeito secundário conhecido do Aduhelm é a ARIA (anomalias imagiológicas relacionadas com a amiloide), tais como edema cerebral e hemorragia no cérebro. Os outros efeitos secundários são:
- reacções alérgicas graves, tais como inchaço da face, lábios, boca ou língua e urticária
- dores de cabeça
- diarreia
- confusão/delírio/alteração do estado mental/desorientação
- quedas
ARIA é um efeito secundário comum que normalmente não causa quaisquer sintomas, mas que pode ser grave. É mais frequentemente observada como um inchaço temporário no cérebro que normalmente se resolve por si só ao longo do tempo. Ao mesmo tempo, a remoção da amiloide do cérebro também remove a amiloide dos vasos sanguíneos, o que pode criar pequenos pontos de hemorragia no cérebro ou na sua superfície.
A ARIA foi observada em 41% dos participantes nos ensaios clínicos que receberam aducanumab, em comparação com 10% dos participantes que receberam um placebo.
Embora a maioria das pessoas com inchaço em áreas do cérebro não apresente sintomas, cerca de 30% das pessoas podem ter sintomas ligeiros, tais como
- confusão
- dores de cabeça
- tonturas
- alterações da visão
- náuseas
Daniel Gibbs, neurologista reformado e participante de longa data nos ensaios clínicos Aduhelm , partilhou a sua experiência com um efeito secundário extremamente raro do ARIA:
"Devo dizer em primeiro lugar, e este é o dogma que é largamente verdadeiro, que [as ARIAs] são normalmente benignas. A maioria das pessoas não sabe que as tem. [As ARIAs só são detectadas em exames de ressonância magnética, onde há pequenas áreas de inchaço ou pequenas áreas de deposição de ferro devido a hemorragias. Se as pessoas tiverem sintomas, estes são normalmente ligeiros. A dor de cabeça é o mais comum, ocasionalmente confusão.
Mas quase sempre, mesmo com ARIA sintomática, se parar o medicamento, os sintomas desaparecem em poucos meses. O medicamento pode ser reiniciado de novo em segurança. Houve muito poucos casos, pelo menos os que foram discutidos pelo fabricante do medicamento Biogen, [de] ARIA catastróficos ou graves, e o meu estava nessa categoria. [...]
Comecei a ter um aumento das dores de cabeça. Não é raro eu ter dores de cabeça, por isso não pensei muito nisso, mas elas tornaram-se um pouco mais frequentes e talvez um pouco mais graves, mas ainda assim aliviadas por [medicamentos] de venda livre. [...]
Depois, uma ou duas noites antes do Natal de 2017, tive a pior dor de cabeça da minha vida, do tipo que nós, neurologistas, associaríamos a uma hemorragia subaracnoideia, uma hemorragia maciça no cérebro. Medi a minha tensão arterial e estava muito alta e manteve-se alta, por isso pensei que estava a ter um AVC.
Pedi à minha mulher que me levasse às urgências e, quando cheguei ao hospital local, não conseguia fazer uma história coerente. [...]
Mas, passados alguns dias, já estava um pouco melhor. A minha dor de cabeça desapareceu, mas continuava a ter dificuldade em ler. No mês seguinte, a situação piorou um pouco. Nessa altura, os meus exames de ressonância magnética mostraram que se tratava de ARIA, com o inchaço e a hemorragia por todo o cérebro. Devido ao facto de ter aumentado, considerou-se que devia ser tratada. Recebi cinco doses de esteróides de alta dosagem e isso aliviou imediatamente a dor de cabeça e a confusão. Mas foram precisos cerca de seis meses para que o inchaço no meu cérebro desaparecesse totalmente".
Tendo em conta estes potenciais efeitos secundários raros mas graves, os prestadores de cuidados de saúde dos doentes terão de efetuar exames de ressonância magnética (RMN) antes e durante o tratamento com Aduhelm para verificar a existência de ARIA.
Aprovação do Aduhelm (aducanumab)
Em 7 de junho de 2021, a FDA concedeu uma aprovação acelerada ao Aduhelm (aducanumab) para o tratamento da doença de Alzheimer.
A aprovação acelerada é um tipo de aprovação que pode ser concedida a medicamentos que demonstrem um efeito terapêutico positivo em ensaios clínicos, antes de terem sido apresentadas todas as provas conclusivas. Esta aprovação só pode ser aplicada a medicamentos para doenças graves que satisfaçam uma necessidade médica não satisfeita; o último medicamento aprovado para o tratamento da doença de Alzheimer foi aprovado há mais de 18 anos.
A aprovação acelerada é concedida condicionalmente. A FDA está a exigir que o fabricante, a Biogen, realize um novo ensaio clínico para verificar os benefícios clínicos do medicamento. Se o ensaio não mostrar benefícios, a FDA pode retirar a aprovação do medicamento. A Biogen tem até 2029 para concluir outro ensaio clínico para confirmar os benefícios do aducanumab para os doentes de Alzheimer; os especialistas argumentam que um terceiro ensaio clínico, que poderia ser concluído em dois anos, teria sido uma opção melhor do que esperar oito anos para descobrir se o medicamento funciona, enquanto os doentes se submetem ao tratamento dispendioso e esperam pelo melhor.
Uma controvérsia médica com implicações financeiras
A decisão da FDA de aprovar o aducanumab intrigou os especialistas que afirmam não haver provas suficientes de que Aduhelm seja um tratamento eficaz para a doença de Alzheimer. Muitos deles, incluindo um painel independente, aconselharam a FDA que as provas disponíveis levantavam dúvidas significativas quanto ao facto de o aducanumab poder abrandar o declínio cognitivo e debateram se os resultados positivos de apenas um dos dois estudos de Fase 3 constituíam uma base suficiente para a aprovação da FDA.
Pouco depois da aprovação, três cientistas demitiram-se em protesto do comité independente que aconselhou a FDA sobre o tratamento, alegando a falta de provas convincentes. Criticaram também a decisão da FDA de aprovar o aducanumab para qualquer pessoa com doença de Alzheimer, apesar de o ensaio ter sido realizado numa fase inicial da doença, e a aceitação da teoria de que a redução da placa amiloide iria efetivamente abrandar os sintomas cognitivos (apesar do desalinhamento da comunidade científica quanto à sua validade).
A decisão da FDA de aprovar o aducanumab nestas condições poderá ter várias ramificações.
- Outros medicamentos que têm como alvo as placas amilóides, como o donanemab da Eli Lilly, poderão ser aprovados mais rapidamente do que o previsto, despertando o interesse das empresas farmacêuticas em investir em medicamentos para a doença de Alzheimer ou em continuar o seu envolvimento nos ensaios existentes.
- A decisão da FDA criou uma perceção de flexibilidade regulamentar que poderia incentivar outras empresas de biotecnologia a desenvolverem medicamentos para doenças raras, um impulso que se esvaziou após uma longa série de fracassos em ensaios clínicos, particularmente nos 18 anos entre as aprovações de tratamentos para a doença de Alzheimer.
- O medicamento é bastante dispendioso, custando 56 000 dólares por ano, o que significa que as taxas dos seguros de saúde privados poderão aumentar, uma vez que as seguradoras terão de o pagar, e que aumentará o ónus para os contribuintes no âmbito do Medicare (o seguro nacional de saúde dos EUA). Há quem diga que poderá ser "devastador" para o Medicare, não só devido aos seus custos de base, mas também porque o tratamento com o Aduhelm exige que os doentes tenham diagnósticos mais precoces com punções lombares para detetar amiloide e monitorização constante com ressonâncias magnéticas (entre outros), o que aumenta significativamente os custos e pressiona os sistemas médicos.
A aprovação é também vista como um ganho inesperado para a Biogen, uma vez que as suas acções subiram mais de 50%, enquanto as acções do parceiro japonês Eisai Co subiram 56%. Os analistas prevêem que Aduhelm poderá gerar vendas de cerca de 10 mil milhões de dólares, tendo em conta que só nos EUA existem 6 milhões de pessoas diagnosticadas com a doença de Alzheimer. O medicamento é importante para o crescimento da Biogen, uma vez que a concorrência prejudicou as vendas dos seus medicamentos - Tecfidera , para a esclerose múltipla (EM), e Spinraza , para a atrofia muscular espinal (AME).
Spinraza é outro medicamento da carteira da Biogen que tem um preço elevado, com um preço de tabela de 750 000 dólares para o primeiro ano de tratamento e 375 000 dólares por ano nos anos seguintes.
Nem toda a gente critica a decisão da FDA de aprovar Aduhelm
Uma vez que a doença de Alzheimer é uma doença progressiva, os doentes precisam de tratamento mais cedo do que mais tarde. A notícia da decisão da FDA deu a muitos uma nova esperança, quer de que o tratamento funcione para si próprios ou para o seu ente querido, quer de que estimule outras empresas a desenvolver outros tratamentos para a doença de Alzheimer.
Os grupos de defesa dos doentes tinham insistido vigorosamente na aprovação, uma vez que existem apenas seis outros tratamentos disponíveis para a doença debilitante, que apenas tratam os sintomas durante alguns meses. Em novembro de 2020, o comité consultivo da FDA votou contra a aprovação do Aduhelm, o que provocou a ira e, em seguida, a ação da Associação de Alzheimer, que fez uma campanha para expressar o seu apoio ao potencial do medicamento e para enfatizar a necessidade de esperança e progresso.
Em janeiro de 2021, a FDA e grupos de doentes reuniram-se numa sessão de auscultação em que doentes, prestadores de cuidados de saúde, médicos e defensores se manifestaram a favor do tratamento, argumentando, entre outras coisas, que os doentes não se podem dar ao luxo de esperar mais tempo por um tratamento.
O Diretor do Gabinete de Novos Medicamentos da FDA, Peter Stein, confirmou durante uma conferência de imprensa que as opiniões dos doentes tiveram um papel importante. Stein afirmou que a FDA "ouviu muito claramente dos doentes que estão dispostos a aceitar alguma incerteza para terem acesso a um medicamento que pode proporcionar um benefício significativo na prevenção da progressão desta doença, que, como todos sabemos, pode ter consequências muito devastadoras".
Patrizia Cavazzoni, a diretora interina do Centro de Avaliação e Investigação de Medicamentos da FDA, disse durante a mesma conferência de imprensa que "os dados apoiam os doentes e os prestadores de cuidados de saúde que têm a opção de utilizar este medicamento".
"Esta aprovação do medicamento pela FDA inaugura uma nova era no tratamento e investigação da doença de Alzheimer", afirmou Maria Carrillo, doutorada, diretora científica da Associação de Alzheimer. "A história tem-nos mostrado que a aprovação do primeiro medicamento de uma nova categoria revigora o campo, aumenta os investimentos em novos tratamentos e incentiva uma maior inovação."
Quando é que Aduhelm será aprovado na Europa?
A doença de Alzheimer está a tornar-se rapidamente uma das maiores crises médicas, económicas e sociais do século - e uma doença difícil de detetar precocemente, especialmente tendo em conta a falta de especialistas na Europa que possam confirmar um diagnóstico. Só na Europa, em 2018, 9,7 milhões de pessoas sofriam da doença de Alzheimer e de outras formas de demência; até 2030, prevê-se que o número de doentes aumente para 14 milhões, criando uma necessidade urgente de tratamentos eficazes.
Aduhelm ainda não foi aprovado fora dos Estados Unidos. A Biogen apresentou um pedido de revisão regulamentar na União Europeia em outubro de 2020, bem como no Japão, Canadá, Austrália e Brasil no final de 2020.
De acordo com a Agência Europeia de Medicamentos (EMA), a avaliação de um pedido de autorização de introdução no mercado de um novo medicamento demora normalmente cerca de um ano, menos se for concedida uma Avaliação Acelerada ao criador do medicamento.
Em março deste ano, a fábrica de 2 mil milhões de dólares da Biogen na Suíça recebeu uma licença de Boas Práticas de Fabrico (BPF) da Agência Suíça de Produtos Terapêuticos (Swissmedic). A Biogen planeia obter a aprovação da FDA para produzir Aduhelm nas instalações suíças no final de 2021 e espera fornecer o medicamento a mais de 1 milhão de doentes por ano.
Acesso ao Aduhelm fora dos Estados Unidos
Aduhelm está atualmente aprovado pela FDA e disponível para residentes nos Estados Unidos - e existem regulamentos que permitem a importação de medicamentos em países onde não estão atualmente aprovados.
Os doentes com doenças debilitantes ou potencialmente fatais têm o direito de aceder, comprar e importar medicamentos com a ajuda dos seus médicos.
Os doentes e os seus médicos podem fazê-lo com base nos regulamentos de uso compassivo ou de importação de doentes nomeados, uma exceção legal à regra geral de que um medicamento só pode normalmente ser acedido após a autorização/aprovação de introdução no mercado (qualquer que seja a formulação utilizada) no país onde o doente vive. Esta exceção permite que os doentes acedam e obtenham, de uma forma legal, ética e segura, medicamentos que ainda não estão aprovados no seu país.
Leia mais sobre a "base do doente nomeado" aqui (EMA).
A everyone.org está empenhada em que os pacientes e os seus médicos possam ter acesso a qualquer medicamento disponível em todo o mundo para o melhor tratamento possível. Operamos com 100% de conformidade com os regulamentos do seu país, se estiver fora dos Estados Unidos. Se quiser ler mais detalhes, aceder ao medicamento ou contactar a nossa equipa de apoio , pode fazê-lo aqui.
Quanto custa o Aduhelm ?
A Biogen anunciou que o custo do Aduhelm na dose de manutenção (10 mg/kg) para um doente médio seria de 56 000 dólares por ano. Este valor não inclui os testes que os doentes têm de efetuar antes do tratamento e durante o mesmo.
A Biogen tem sido alvo de críticas relativamente ao elevado preço do medicamento por ano.
O Institute for Clinical and Economic Review (ICER), uma organização sem fins lucrativos que analisa os preços dos medicamentos, indicou que um preço anual justo variaria entre 2 500 e 8 300 dólares por doente e por ano. Numa declaração, o ICER afirmou que a aprovação da FDA não protegeu os doentes e que a Biogen poderia receber mais de 50 mil milhões de dólares por ano "mesmo enquanto espera por provas que confirmem que os doentes recebem benefícios reais do tratamento".
O diretor executivo da Biogen, Michel Vounatsos, respondeu às críticas afirmando que o preço do medicamento se justifica pelo valor que trará aos doentes e a uma sociedade menos sobrecarregada pela doença de Alzheimer, e que o preço é o reflexo de "duas décadas sem inovação". "É altura de investir no tratamento", acrescentou.
Na everyone.org, não podemos influenciar o preço estabelecido pela Biogen. Podemos ajudar os doentes a aceder ao Aduhelm aos seguintes preços:
- 1 958,58 euros por um frasco para injectáveis de 170 mg/1,7 ml (100 mg/mL)
- 3 046,68 euros por um frasco para injectáveis de 300 mg/3 ml (100 mg/mL)
Para mais informações, faça um pedido de informação aqui.
Tratamentos futuros para a doença de Alzheimer
Um estudo publicado em maio de 2021 revela que existem atualmente 126 tratamentos em ensaios clínicospara a doença de Alzheimer. 82,5% deles visam a modificação da doença, 10,3% melhoram a cognição e 7,1% concentram-se no alívio dos sintomas neuropsiquiátricos.
- Ensaios de fase 3: 28 tratamentos (incluindo aducanumab)
- Ensaios de fase 2: 74 tratamentos
- Ensaios de fase 1: 24 tratamentos
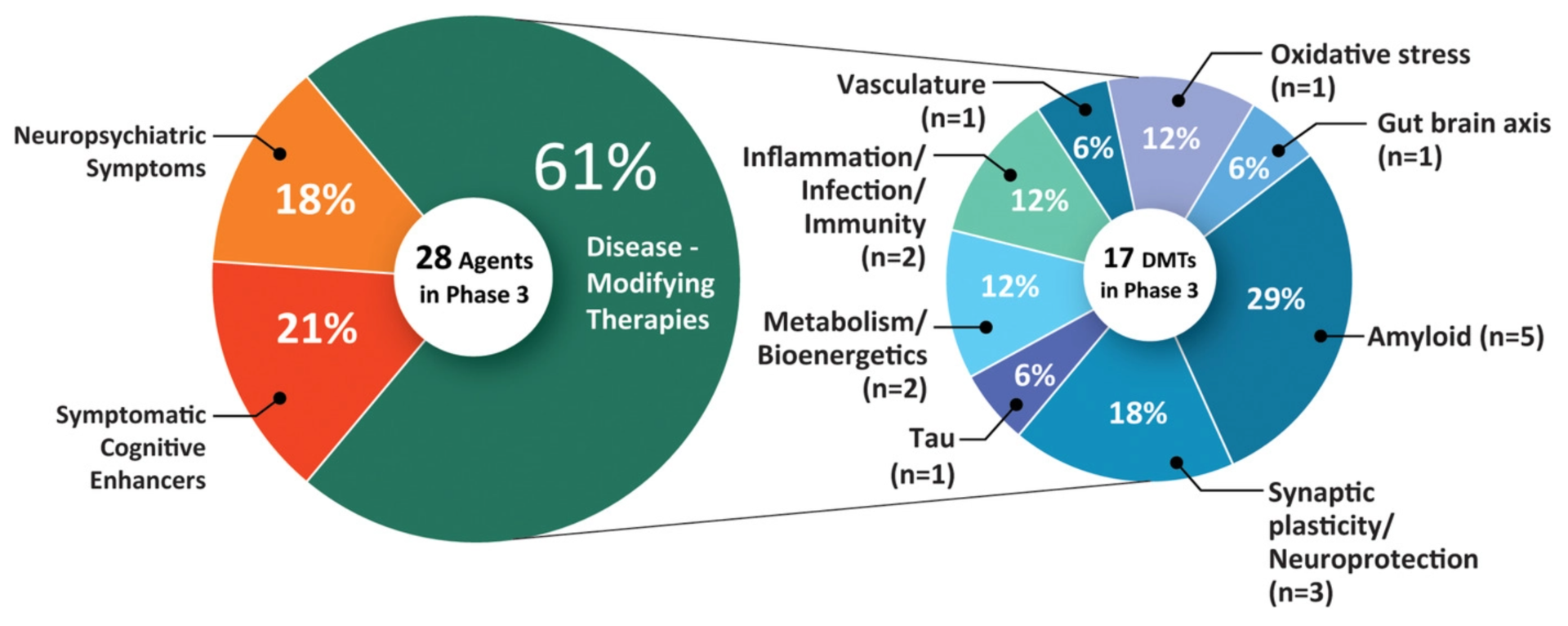
Os tratamentos em fase 3 de ensaios têm maior probabilidade de serem aprovados no próximo ano.
Lecanemab
Funcionando de forma semelhante ao aducanumab (activando o sistema imunitário para remover as placas beta-amilóides), o anticorpo monoclonal lecanemab mostra-se promissor, de acordo com os relatórios publicados, tendo passado à fase 3 dos ensaios clínicos.
Gantenerumab
O gantenerumab liga-se à beta-amiloide, particularmente às placas de beta-amiloide em comparação com a beta-amiloide individual que está a circular no sangue. Pensa-se que dissolve as placas amilóides e remove a beta-amiloide através da estimulação da fagocitose, um processo em que uma célula leva uma determinada molécula para dentro de si e a digere. Estudos clínicos anteriores do gantenerumab mostraram que reduziu a placa beta-amiloide em pessoas com a forma mais comum da doença de Alzheimer que não é diretamente causada por mutações genéticas. Continua a ser estudado em dois grandes estudos globais de Fase III.
Solanezumab
O solanezumab é um anticorpo que tem como objetivo "limpar" a beta-amiloide do sangue e do líquido cefalorraquidiano, impedindo assim a formação de placas. Os benefícios foram registados nos participantes que participaram durante todo o período de três anos e meio dos ensaios, e menos nos participantes que aderiram mais tarde, pelo que ainda há mais a aprender sobre os seus efeitos.
Donanemab
O donanemab parece ser outro medicamento promissor para o tratamento da doença de Alzheimer. Está a ser testado pela Eli Lilly and Company, que planeia inscrever 1500 participantes num grande estudo para confirmar os resultados do seu estudo mais pequeno; este estudo anterior durou 76 semanas e incluiu 257 doentes e, de acordo com os relatórios, mostrou que o donanemab abrandou significativamente o progresso da doença de Alzheimer.
Outros
O saracatinib é um composto experimental que actua como inibidor de uma proteína chamada Fyn quinase, que contribui para a formação de placas beta-amilóides. Um estudo realizado em ratos mostrou que o saracatinib, ao inibir a Fyn quinase, foi eficaz na reversão da perda de memória em ratos. A inibição da Fyn quinase pode prevenir ou atrasar a progressão da doença.
Os investigadores do Instituto Salk de Estudos Biológicos, na Califórnia, estão a estudar uma substância química chamada fisetina e desenvolveram uma versão da fisetina chamada CMS121, que descobriram ser eficaz no abrandamento da perda de células cerebrais. É necessária mais investigação antes de um medicamento estar pronto para ser aprovado.
Relativamente à recente aprovação do Aduhelm, Maria Carrillo, Chief Science Officer do grupo de defesa dos doentes Alzheimer's Association em Chicago, EUA, afirmou numa declaração à Nature: "Estamos esperançados e este é o começo - tanto para este medicamento como para melhores tratamentos para a doença de Alzheimer".
"Tudo o que realmente somos são os nossos pensamentos e o nosso cérebro." - Sandy, antiga dentista e professora assistente e doente de Alzheimer.
Na everyone.org, estamos convencidos de que a ciência faz avançar a raça humana e melhora ou até salva vidas. A doença de Alzheimer está a pôr em risco a qualidade de vida de muitas pessoas. Encorajamos os cientistas que se dedicam a encontrar uma (parte da) solução a perseverar e esperamos que os tratamentos em desenvolvimento com resultados promissores sejam aprovados e se tornem acessíveis aos doentes de Alzheimer em todo o mundo nos próximos 3 anos.




