Enhertu para o cancro do pulmão: Onde está aprovado e como obtê-lo?
Última atualização: 15 de julho de 2024
Pode aceder legalmente a novos medicamentos, mesmo que estes não estejam aprovados no seu país.
Saiba comoEnhertu (fam-trastuzumab deruxtecan-nxki) tem sido um dos tratamentos contra o cancro a observar, desde a sua primeira aprovação pela FDA em 2019 1.
Como a segurança e a eficácia de Enhertu no cancro do ovário e no cancro colorrectal ainda estão a ser investigadas, o medicamento já está aprovado para várias indicações. Incluindo o cancro da mama HER2-positivo, o cancro gástrico HER2-positivo e o cancro da mama HER2-baixo. A FDA também aprovou o Enhertu para o cancro do pulmão de células não pequenas com mutação HER2. O CHMP na Europa emitiu recentemente um parecer positivo para fazer o mesmo na UE 2.
Se é um doente com cancro do pulmão no Reino Unido ou em qualquer outro país fora dos EUA e da UE, deve estar a perguntar-se quando é que o Enhertu também estará disponível para si.
Aqui está tudo o que deve saber sobre Enhertu para o cancro do pulmão e o que os doentes no Reino Unido e no resto do mundo podem esperar.
Qual é a indicação para Enhertu para o cancro do pulmão?
Como terapia-alvo, o Enhertu destina-se apenas ao tratamento de cancros com uma mutação HER2. Como tal, o tratamento aplica-se a cerca de 2% de todos os doentes com NSCLC 3.
Enhertu é indicado como monoterapia em doentes adultos com CPNPC avançado cujos tumores têm uma mutação HER2 activadora (ERBB2). Enhertu destina-se a doentes que receberam uma terapia sistémica prévia e cujo cancro se espalhou para outras partes do corpo ou não pode ser removido cirurgicamente 2.
Qual é a taxa de sucesso do Enhertu para o cancro do pulmão?
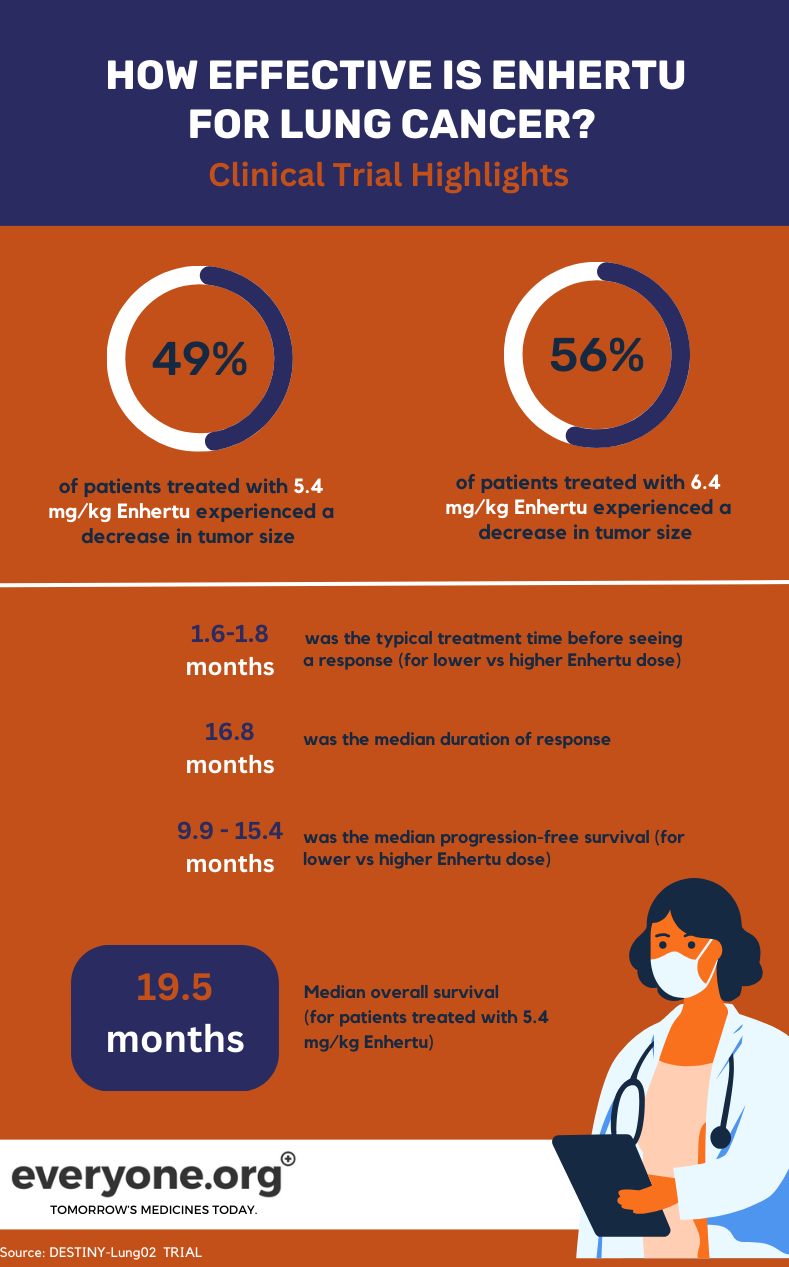
O ensaio de Fase II DESTINY-Lung02 em curso está a investigar a segurança e a eficácia do Enhertu no tratamento do CPNPC com mutações HER2. Neste ensaio, estão a ser comparadas duas doses de Enhertu (5,4 mg/kg e 6,4 mg/kg).
Para os doentes com cancro do pulmão, os principais resultados preliminares do ensaio DESTINY-Lung02 são os seguintes
- Os tumores diminuíram em 49% dos doentes tratados com a dose mais baixa Enhertu e em 56% dos doentes tratados com a dose mais elevada.
- Os tumores desapareceram completamente em 1% e 4% dos doentes do grupo de dose inferior e superior, respetivamente.
- A duração mediana da resposta foi de 16,8 meses para os doentes no grupo de dose mais baixa de Enhertu . Para os pacientes do outro grupo, a DoR foi relatada como não estimável.
- O tempo mediano necessário para observar a resposta inicial ao tratamento foi de 1,8 meses e 1,6 meses no grupo de dose inferior e superior, respetivamente.
- A mediana da sobrevivência sem progressão foi de 9,9 meses com 5,4 mg/kg e de 15,4 meses com 6,4 mg/kg 4.
Qual foi a sobrevivência média para os doentes do Enhertu ?
Para os doentes que receberam a dose mais baixa de Enhertu no ensaio clínico, a sobrevivência global mediana (OS) foi de 19,5 meses. A OS foi comunicada como não estimável para o grupo de dose mais elevada 4.
Quais são os efeitos secundários do Enhertu nos pulmões?
Foram notificados alguns casos graves, com risco de vida ou fatais, de doença pulmonar intersticial (DPI) em doentes com Enhertu . Os doentes com insuficiência renal moderada podem estar sujeitos a um risco mais elevado 6.
No ensaio DESTINY-Lung02, a DPI foi registada em 12,9% dos doentes no grupo de dose mais baixa e em 28% dos doentes no grupo de dose mais elevada. A maioria destes casos não era grave. A DPI de grau 3 ou superior foi registada em 2% dos doentes em ambos os grupos de doentes.
Enhertuno cancro do pulmão é semelhante ao seu desempenho noutras indicações. Com base na menor incidência de efeitos adversos (38,6% vs 58%), a dose de 5,4 mg/kg é considerada o tratamento ótimo para os doentes com NSCLC 4.

Onde está Enhertu aprovado para o cancro do pulmão?
Atualmente, o Enhertu está aprovado nos EUA, na UE, em Israel e no Japão para o tratamento de doentes adultos com CPNPC irressecável ou metastático cujos tumores têm mutações activadoras do HER2 (ERBB2) 4.
O Enhertu está aprovado para o cancro do pulmão no Reino Unido?
A partir de julho de 2024, ainda não. Um projeto final de orientação publicado pelo NICE em março de 2024 anunciou que Enhertu não estará no NHS até que esteja disponível um preço rentável. Entretanto, infelizmente, o Enhertu não está disponível no Reino Unido para o cancro do pulmão 7.
O meu médico pode prescrever Enhertu para o cancro do pulmão se ainda não tiver sido aprovado?
A resposta curta é sim.
Enhertu já foi aprovado em vários países para o tratamento do CPNPC com mutação HER2. Com base neste facto, o seu médico tem autoridade para prescrever o medicamento para esta indicação, mesmo que ainda não tenha sido aprovado no seu país.
Quando um médico prescreve um medicamento para tratar uma doença para a qual não está aprovado (ainda), chama-se a isso utilização não contemplada na rotulagem. Uma prescrição para uso não autorizado pode ser difícil de aviar em alguns países, dependendo dos regulamentos e da disponibilidade locais. No entanto, é sempre possível aviá-la utilizando o regulamento de importação de doentes nomeados.
O seu médico tomou a decisão de prescrever Enhertu para o tratamento do seu cancro do pulmão? A nossa equipa em www.everyone.org pode ajudá-lo a aceder ao medicamento. Somos especializados no fornecimento e entrega de medicamentos prescritos não aprovados ou não disponíveis no país do doente. Contacte-nos, para que o possamos ajudar.
Referências:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) Histórico de aprovação da FDA. Drugs.com, 15 de agosto de 2022.
- Enhertu. Agência Europeia de Medicamentos, Acedido em 06 de novembro de 2023.
- HER2 e cancro do pulmão. American Lung Association, Acedido em 6 de novembro de 2023.
- Enhertu demonstrou respostas tumorais fortes e duradouras em cancro do pulmão avançado com mutação HER2 previamente tratado no ensaio de fase II DESTINY-Lung02. AstraZeneca, 11 de setembro de 2023.
- Informações sobre o projeto | Trastuzumab deruxtecan para o tratamento do cancro do pulmão não escamoso de células pequenas com mutação HER2, irressecável ou metastático, após 1 ou mais terapias [ID3934] | Orientação. NICE, Acedido em 6 de novembro de 2023.
- USPI-DB-04 CDX Atualização FINAL. Daiichi Sankyo, Acedido em 6 de novembro de 2023.
- UK NICE rejects Daiichi Sankyo's Enhertu for breast cancer, Pharmaceutical Technology, Accessed 15 July 2024.