Qual é a diferença entre Leqembi e Aduhelm? Uma visão geral simples.
Última atualização: 19 de novembro de 2024
Pode aceder legalmente a novos medicamentos, mesmo que estes não estejam aprovados no seu país.
Saiba comoDesde 2021, a FDA concedeu aprovação acelerada a dois novos medicamentos para a doença de Alzheimer. Estes medicamentos são as terapias anti-amiloide Leqembi (lecanemab) e Aduhelm (aducanumab). Ambas as aprovações ocorreram após quase 20 anos sem grandes avanços no tratamento da doença de Alzheimer. Por este motivo, ambos os medicamentos foram objeto de grande atenção por parte dos meios de comunicação social.
No entanto, a receção tem sido mista. Maria Carrillo, diretora científica da Associação de Alzheimer, referiu-se à aprovação dos novos medicamentos como "um marco importante para as pessoas elegíveis para este tratamento" [2]. Ao mesmo tempo, o seu processo de aprovação tem sido rodeado de controvérsia, especialmente no caso do Aduhelm [1, 4].
Como paciente, deve estar a perguntar-se qual é a diferença entre o Leqembi (lecanemab) e o Aduhelm (aducanumab). Neste artigo, vamos comparar os dois medicamentos quanto à forma como actuam, à sua eficácia, bem como ao seu custo e disponibilidade.
Leqembi vs Aduhelm: Para que é que são utilizados?
Ambos os medicamentos são tratamentos para a doença de Alzheimer precoce. São terapias anti-amilóides e têm como alvo as placas amilóides no cérebro.
De acordo com a sua informação de prescrição, o Leqembi e o Aduhelm destinam-se a doentes com défice cognitivo ligeiro e com níveis elevados confirmados de beta-amiloide [5].
Leqembi vs Aduhelm: Como é que funcionam?
Semelhanças
O Leqembi (lecanemab) e o Aduhelm (aducanumab) são ambos anticorpos monoclonais. Foram concebidos para atacar as placas beta-amilóides que se acumulam no cérebro dos doentes de Alzheimer. Pensa-se que estas placas contribuem para o declínio cognitivo e o declínio clínico observados nesta doença.
Ambos os medicamentos se ligam e neutralizam as placas amilóides, com o objetivo de retardar a progressão da doença. É isto que torna o Leqembi e Aduhelm fundamentalmente diferentes dos tratamentos anteriores para a doença de Alzheimer, como a galantamina, a rivastigmina e o donepezil. Estes tratamentos anteriores centram-se no alívio dos sintomas da doença. O Leqembi e Aduhelm têm como objetivo alterar o curso da doença, visando a sua causa principal.
Diferenças
O Leqembi e o Aduhelm ligam-se a diferentes partes da proteína beta-amiloide. Aduhelm liga-se mais fortemente às placas amilóides maiores e endurecidas. O Leqembi tem como alvo preferencial a forma mais pequena e solúvel (e mais tóxica) da proteína amiloide [6].
Qual é a eficácia de Leqembi e Aduhelm?
A eficácia do Leqembi (lecanemab) e do Aduhelm(aducanumab) foi estudada em ensaios clínicos.
-
Resultados do ensaio clínico Leqembi
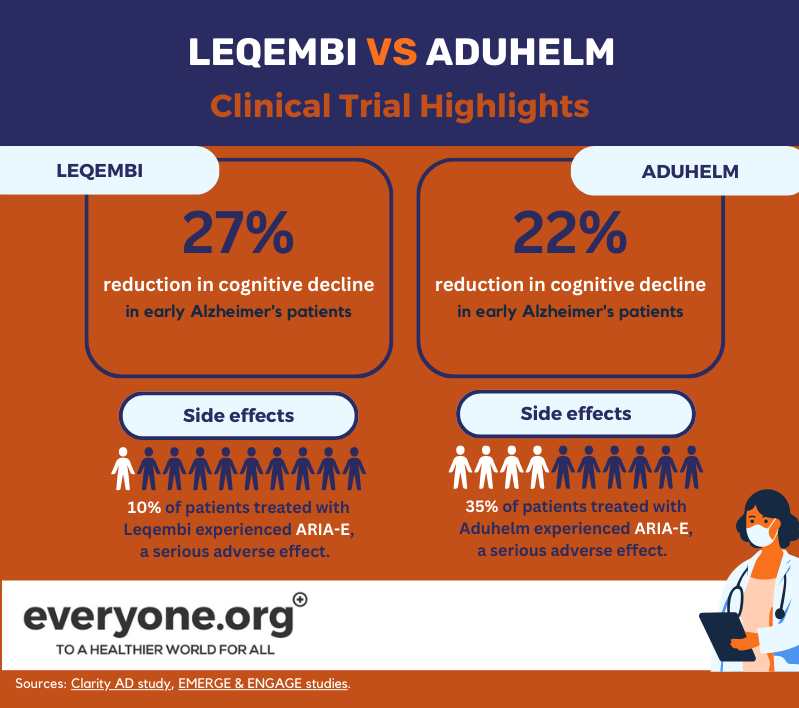
A aprovação acelerada do Leqembi pela FDA baseou-se nos resultados positivos de primeira linha do estudo Clarity AD de Fase 3. De acordo com estes resultados, o Lecanemab abrandou o declínio cognitivo até 27% em doentes com Alzheimer inicial, em comparação com o placebo. Estes resultados foram medidos 18 meses após o início do tratamento [8].
Em abril de 2023, foi publicada uma análise adicional dos resultados do estudo. Esta análise demonstrou que, mesmo depois de os doentes terem deixado de tomar o Leqembi durante um período de 9 a 59 meses, continuaram a beneficiar de um atraso no declínio cognitivo. Durante este "período de hiato", a doença de Alzheimer parecia progredir a um ritmo consistentemente mais lento nos doentes que receberam Leqembi no ensaio clínico original, em comparação com os que receberam placebo [7].
O efeito adverso grave da ARIA-E ocorreu em 10% dos doentes tratados com Leqembi. 6% dos pacientes no ensaio experimentaram ARIA-H, outro efeito adverso grave [13].
-
Resultados dos ensaios clínicos do Aduhelm
A FDA concedeu a sua aprovação acelerada ao Aduhelm com base em dois ensaios clínicos de Fase 3. Um deles (EMERGE) mostrou uma redução no declínio clínico dos pacientes de até 22% [12]. O outro (ENGAGE) não o fez. No entanto, em ambos os estudos, Aduhelm demonstrou uma redução das placas amilóides no cérebro [9]. A FDA decidiu que esta indicação tem "uma probabilidade razoável de resultar num benefício clínico" [10].
Um ensaio de confirmação de Fase 4 (ENVISION) teve início em junho de 2022, a pedido da FDA. Os resultados são esperados em 2026 [9].
De acordo com a informação de prescrição do Aduhelm, 35% dos doentes que receberam o medicamento em ensaios clínicos sofreram ARIA-E. 34% dos pacientes dos ensaios experimentaram ARIA-H [15].
Como estes dados actuais mostram, a principal diferença entre o Leqembi e Aduhelm nesta altura parece estar no seu perfil de segurança, com o Leqembi a mostrar uma menor incidência de efeitos adversos.
Ao mesmo tempo, com base nos dados dos ensaios clínicos actuais, o Leqembi parece ter um efeito mais consistente no declínio cognitivo. Os resultados dos ensaios em curso sobre o Leqembi e Aduhelm permitirão esclarecer melhor o desempenho de ambos os medicamentos.
NOTA: Os resultados aqui partilhados são para fins informativos e não devem ser utilizados como base para uma escolha de tratamento. O seu médico está na melhor posição para determinar o tratamento que melhor se aplica ao seu caso.

Leqembi vs Aduhelm: Segurança e efeitos secundários
De acordo com a sua informação de prescrição, estes são os efeitos secundários mais comuns do Leqembi (lecanemab) e do Aduhelm:
Efeitos secundários do Leqembi
- reacções relacionadas com a perfusão, incluindo febre, sintomas semelhantes aos da gripe, náuseas, alterações do ritmo cardíaco e falta de ar;
- dor de cabeça;
- Anomalias imagiológicas relacionadas com a amiloide (ARIA) [13]. As ARIA podem envolver inchaço temporário ou hemorragia no cérebro. Os sintomas da ARIA são dores de cabeça, confusão, convulsões, dificuldade em andar e tonturas. Os portadores do gene homozigótico da apolipoproteína E podem ter um risco mais elevado de ARIA [14].
Efeitos secundários do Aduhelm
Os efeitos secundários mais frequentes do Aduhelm são ARIA, dores de cabeça e queda. Uma reação adversa especificada para o Aduhelm , mas não para o Leqembi, é a hipersensibilidade. As reacções de hipersensibilidade podem incluir angioedema (inchaço das camadas mais profundas da pele) e urticária (erupção cutânea) [15].
Leqembi vs Aduhelm: Comparação de preços
Quando se trata de medicamentos que ainda não estão amplamente disponíveis, deve considerar qualquer preço apenas como uma indicação. Os custos finais tendem a variar consoante a sua localização, os fornecedores ou a cobertura do seguro.
Para se ter uma ideia, um frasco de dose única de Leqembi custa aproximadamente 1 043 euros. Com a administração bissemanal recomendada do medicamento, os custos anuais para uma pessoa elevam-se a cerca de 27 118 euros [16].
O preço indicativo do Aduhelm por frasco de dose única é de 1 335 euros. Em termos de custos anuais para uma pessoa, este valor ascende a 34.710 euros [17].
Onde é que Leqembi e Aduhelm são aprovados?
Atualmente, o Leqembi (lecanemab) só está aprovado nos EUA e no Reino Unido, estando a sua aprovação pela EMA prevista para o final de 2024[3]. O Leqembi também apresentou pedidos de autorização de introdução no mercado na China e no Japão [18, 19, 20].
Aduhelm (aducanumab) obteve aprovação acelerada pela FDA nos EUA em junho de 2021. A Agência Europeia de Medicamentos (EMA) rejeitou o pedido de comercialização do Aduhelm em dezembro de 2021. O pedido foi posteriormente retirado pela Biogen em abril de 2022 [21]. O Ministério da Saúde do Japão também enviou um sinal negativo sobre a aprovação do Aduhelm no país [22].
O Leqembi ou Aduhelm não estão (ainda) aprovados ou disponíveis no seu país? Se você e o seu médico são da opinião de que estes tratamentos o podem beneficiar, entre em contacto com a nossa equipa de especialistas em acesso médico. Podemos fornecer-lhe um orçamento personalizado para obter o medicamento para si.
Referências:
- O anticorpo monoclonal anti-amiloide Lecanemab: 16 notas de advertência. Zenodo, 3 de janeiro de 2023.
- João Paulo II A FDA concede aprovação acelerada ao medicamento para Alzheimer Leqembi: Shots - Health News. NPR, 6 de janeiro de 2023.
- O Comité Consultivo da FDA vota por unanimidade para confirmar o benefício clínico do LEQEMBI® (lecanemab-irmb) para o tratamento da doença de Alzheimer. Biogen | Relações com Investidores, 9 de junho de 2023.
- Helmore, Edward. A FDA está a ser criticada pela aprovação do medicamento para a doença de Alzheimer Aduhelm. The Guardian, 29 de dezembro de 2022.
- DESTAQUES DA INFORMAÇÃO DE PRESCRIÇÃO. Leqembi, Acedido em 3 de agosto de 2023.
- Taylor, Emma. Novo tratamento para a doença de Alzheimer, lecanemab, faz as manchetes: o que se segue? Alzheimer's Research UK, 13 de dezembro de 2022.
- Eisai: Os doentes de Alzheimer vêem os benefícios do Leqembi mesmo quando este é interrompido. CNBC, 6 de abril de 2023.
- Leqembi | ALZFORUM. Alzforum, 30 de maio de 2023, Acedido a 3 de agosto de 2023.
- Aduhelm | ALZFORUM. Alzforum, 6 de fevereiro de 2023, Acedido em 3 de agosto de 2023.
- Cavazzoni, Patrizia. Decisão da FDA de aprovar um novo tratamento para a doença de Alzheimer. FDA, 7 de junho de 2021.
- Eisai apresenta os resultados completos do ensaio de fase III Clarity AD com lecanemab. Alzheimer Europe, 30 de novembro de 2022.
- Resultados de primeira linha do EMERGE e ENGAGE: Dois Estudos de Fase 3 para Avaliar o Aducanumab em Pacientes com Doença de Alzheimer Precoce. Biogen | Investor Relations, Acedido a 3 de agosto de 2023.
- ID de referência: 5105416. Accessdata.fda.gov, Acedido em 3 de agosto de 2023.
- GUIA DE MEDICAMENTOS LEQEMBI® (leh-kem'-bee) (lecanemab-irmb) injeção, para uso intravenoso. Leqembi, Acedido em 3 de agosto de 2023.
- DESTAQUES DA INFORMAÇÃO DE PRESCRIÇÃO. Accessdata.fda.gov, Acedido a 3 de agosto de 2023.
- Comprar Leqembi (lecanemab-irmb) Online - Preço e Custos. Everyone.org, Acedido a 3 de agosto de 2023.
- Comprar Aduhelm (aducanumab-avwa) Online - Preço e Custos. Everyone.org, Acedido a 3 de agosto de 2023.
- A EISAI APRESENTA UM PEDIDO DE AUTORIZAÇÃO DE COMERCIALIZAÇÃO PARA O LECANEMAB COMO TRATAMENTO DA DOENÇA DE ALZHEIMER PRECOCE NA EUROPA | Biogen. Biogen | Relações com Investidores, 10 de janeiro de 2023.
- Eisai inicia a apresentação de dados de BLA para Lecanemab na China | Biogen. Biogen | Relações com investidores, 22 de dezembro de 2022.
- Carvalho, Teresa, e Ray Burow. Lecanemab, para a doença de Alzheimer precoce, está a ser analisado no Japão. Alzheimer's News Today, 14 de março de 2022.
- Atualização sobre a submissão regulamentar do Aducanumab na União Europeia | Biogen. Biogen | Relações com Investidores, 22 de abril de 2022.
- Swift, Rocky, et al. Eisai-Biogen Alzheimer's drug difficult to assess-Japan ministry. Reuters, 22 de dezembro de 2021.